该指南草案主要适用于同种异体细胞(包括细胞库)产品以及含有异体细胞或细胞生物成分的组合产品(药物组合或药械组合)。此外,该指南的指导建议同样适用于病毒或质粒载体改造修饰的异体细胞和基因编辑后的细胞,但不适用于生产非细胞类产品(如病毒、基因治疗载体或重组蛋白)时使用的细胞物料。指南中具体提到了使用三种不同类型细胞生产的产品,分别是连续细胞系(Continuous cell lines)、原代细胞(Primary Cell)和给少数人或者个体使用的细胞(Cells That Are Administered To A Few Individuals Or A Single Individual)。
细胞产品第一要点就是其安全性。采集异体细胞时,供者筛查和检测必须符合21 CFR 1271, subpart C的要求(满足21 CFR 1271.90(a)要求的细胞除外)。IND申报材料中需要提供生产中使用的所有物料的信息,包括物料的质量或等级、试剂的来源与成分、检测报告(Certificate of Analysis)。细胞安全性以及安全检测程度取决于细胞增殖潜力以及细胞产品应用于多少个体。针对上述提到的三种不同类型细胞生产的产品,对其细胞有不同的检测要求。
连续细胞系(Continuous cell lines):包括诱导多能干细胞(induced pluripotent stem cells)、胚胎干细胞(embryonic stem cells)、癌细胞系(cancer cell lines)和转化细胞系(transformed cell lines)。为确保生产的细胞产品的原材料一致,通常由连续细胞系生产的细胞产品要建立细胞库。细胞库检测参见“A. 主细胞库(MCB)检测”表格。
原代细胞(Primary Cell):包括两种,即可以高度扩增(Extensive Expansion)的细胞和只能有限次传代扩增(Limited Expansion)的细胞。
• 可以高度扩增的细胞:如果来源于单一供体的异体原代细胞经扩大培养后能够满足多数患者治疗,那么建议按照“A. 主细胞库(MCB)检测”要求对细胞进行检测,通常对冻存细胞库检测。但有些生产商生产细胞产品时并不建库,而是对细胞进行大量扩增,直接冻存一批原料药(drug substance)或制剂(drug product)。这种情况就要对冻存的细胞批进行检测,检测要求同“A. 主细胞库(MCB)检测”。
• 只能有限次传代扩增的细胞:这类原代细胞经可以扩增用于生产细胞治疗产品,或用于建立中小型细胞库或用于单批细胞生产以供有限个体使用。这类细胞检测可以简化。参考“B. 主细胞库(MCB)或批细胞检测”表格。
给少数人或者个体使用的细胞(Cells That Are Administered To A Few Individuals Or A Single Individual):通常这类细胞不需要进行细胞遗传学分析或外源病毒因子检测,但如果生产中使用了人源或动物源性试剂,特定的外源病毒检测仍然需要。另外,像无菌、内毒素这样的基本安全性检测是必要的。
高度扩增细胞检测
本节涉及的库检测适用于前面提到的连续细胞系建的库和可以高度扩增的细胞库。生产中如果建了多个级别细胞库,并不是所有的细胞库都要开展安全检测。比如,用于干细胞基因工程的细胞起始材料可以建库,但不视为主细胞库(master cell bank);而经过基因工程修饰后的干细胞建库才认为是主细胞库。所以,应对基因修饰后的细胞库开展安全检测。同样,如果供者细胞作为起始物料,在对细胞进行培养扩增前建库了,也应该是对扩增后的细胞定义为主细胞库。但是,如前文所述,有时候这类细胞产品生产时不会建库,而是直接冻存一批细胞制剂,那么就要对冻存细胞批开展安全检测。下面表格是对主细胞库或细胞生产批建议的检测内容,对工作细胞库(WCB),可以只检测无菌、支原体、鉴别项、体外法外源病毒因子。
A. 主细胞库(MCB)检测
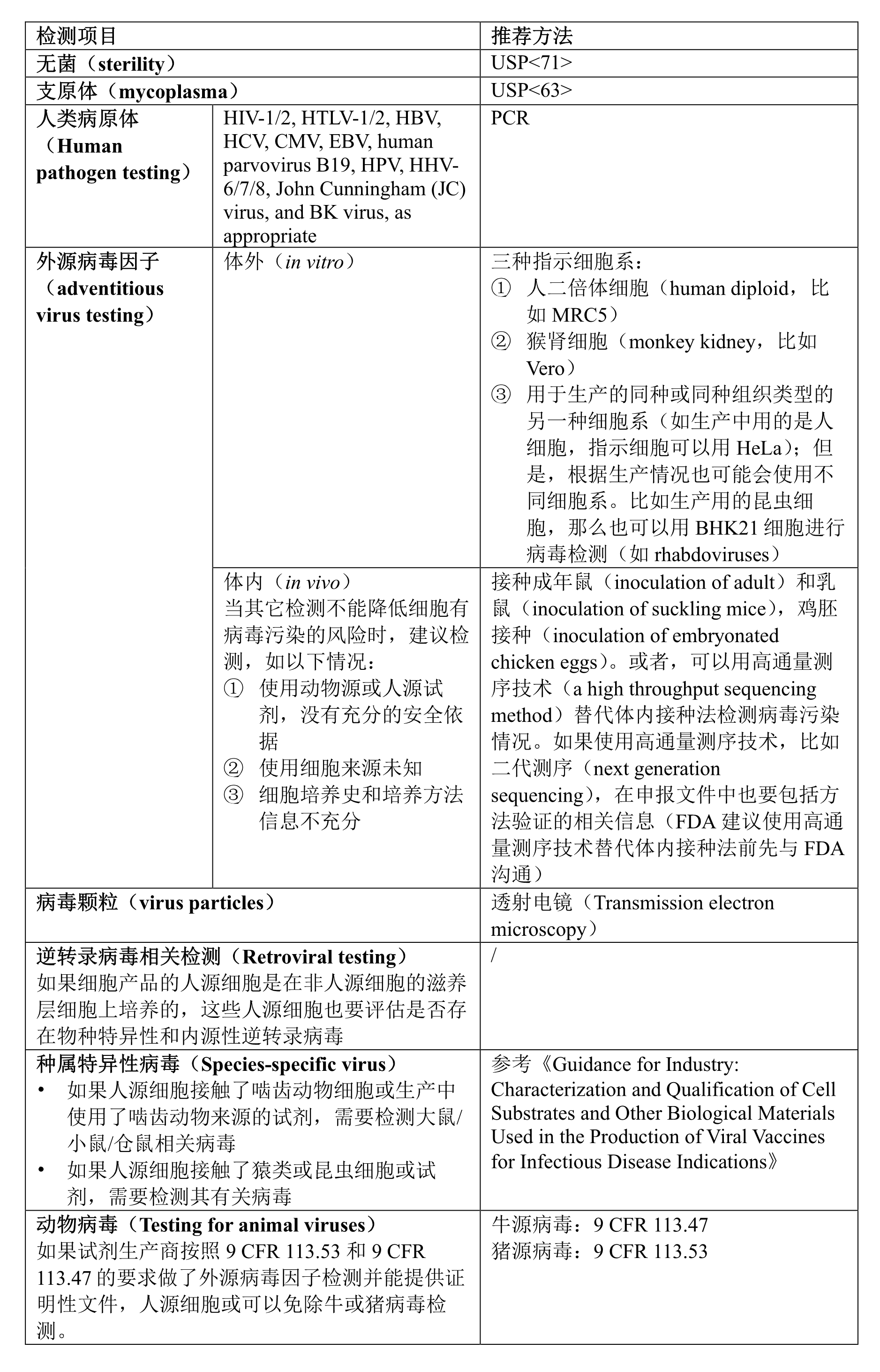

“/”表示指南中未明确
有限扩增细胞检测
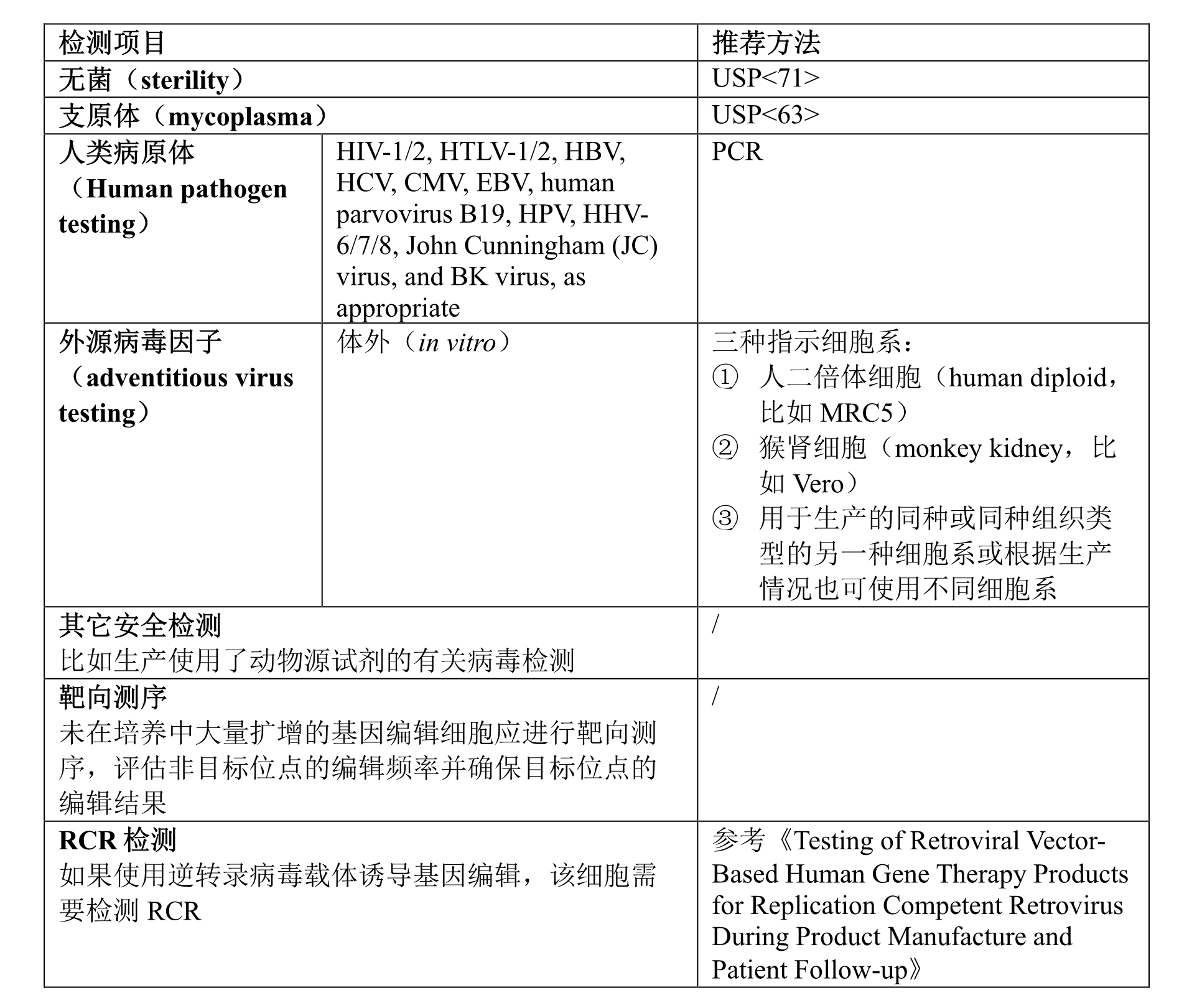
本节库检测或批细胞检测适用于不能广泛扩增的原代细胞。用增殖能力有限的细胞构建的细胞库或生产的细胞制剂可简化检测项目。检测内容参考以下表格。如果对外源病毒因子检测需要消耗大量的细胞样品,那么可以检测生产终末细胞(end of production cell, EOPC)。EOPC样品可以通过对批细胞或细胞库细胞扩增已达到符合检测要求的细胞数量。
B. 主细胞库(MCB)或批细胞检测
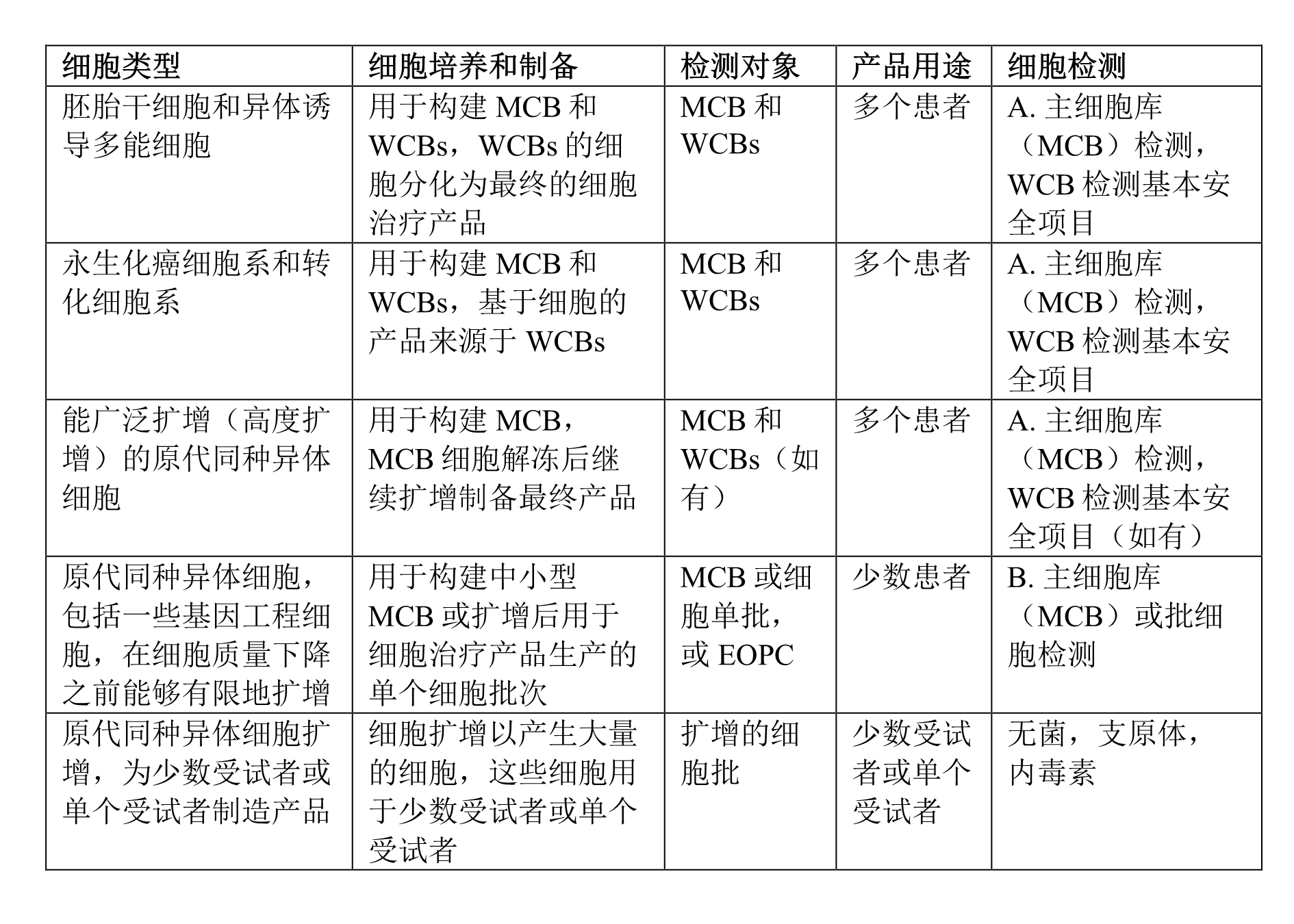
为便于更加直观的呈现符合上述两个库检测要求的细胞产品类型,指南中也提供了详细列表: