基因编辑定义
利用核酸酶等方法将人体基因组中的DNA序列进行定点插入、删除或替换的过程。核酸酶可使DNA单链或双链在特定位点上发生断裂,尔后依赖细胞修复机制达到基因编辑的目的。细胞修复包括非同源末端连接(non-homologous end-joining,NHEJ)和同源重组修复(homology directed repair,HDR)两种机制。
核酸酶基因编辑种类
• 内切酶(Meganucleases):一种工程化以后的自引入内切酶(homing endonucleases),同时具备核酸酶切割活性和靶向识别功能。
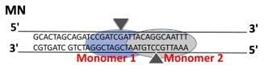
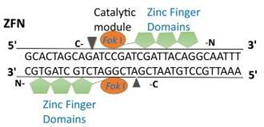
• 锌指核酸酶(Zinc Finger Nucleases, ZFNs):由DNA识别域(锌指蛋白)和DNA切割域(限制性内切酶FokI切割域)融合而成,通常能识别DNA的9-18对碱基。
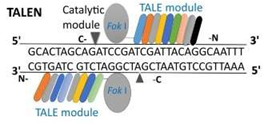
• 转录激活因子样效应核酸酶(Transcription Activator-Like Effector Nucleases, TALENs):也是与FokI内切酶融合,可以识别约20对碱基。
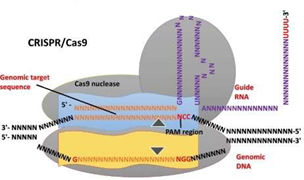
• CRISPR/Cas系统(Clustered Regularly Interspaced Short Palindromic Repeats):包含Cas蛋白和向导RNA(gRNA)的核糖核蛋白复合物。Cas蛋白识别目标序列附近的PAM序列,并引起DNA解双螺旋,然后gRNA与其中一条目标DNA序列配对结合,Cas蛋白与gRNA复合物结构域发生变化激活Cas蛋白的核酸内切酶结构域发挥切割DNA链的作用,最终形成双链断裂(Double Strand Break, DSB)。
核酸酶基因编辑原理都是基于DNA自身的修复机制,即 NHEJ和HDR。NHEJ是直接将两条断裂的DNA进行连接,在这个过程中可能会发生意外删除或插入碱基序列的错误修复。HDR则需要同源DNA序列作为模板进行修复,相对NHEJ更加精准。
核酸酶基因编辑系统的变体
碱基编辑(base editor)和引导编辑(prime editor)是两种在CRISPR/Cas系统的基础上开发的核酸酶基因编辑技术。这两种编辑方法都利用了Cas9的变体,即Nickase Cas9(nCas9),它只有一个内切酶发挥单链切割的作用,从而不会引起DNA的双链断裂。
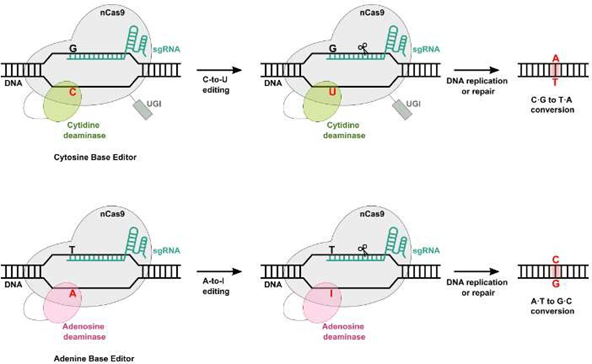
碱基编辑通过将nCas9与一种特定的脱氨酶结合,来实现将特定的碱基转化为另一个碱基。比如胞嘧啶脱氨酶(cytosine deaminase)将DNA中的胞嘧啶(Cytosine, C)脱氨为尿嘧啶(Uracil, U),在DNA复制或修复过程中,U会被视为胸腺嘧啶(Thymine, T),因此最终实现C→T的碱基转换;同样,腺嘌呤脱氨酶(adenosine deaminase)将DNA中的腺嘌呤(Adenine, A)脱氨为次黄嘌呤(Inosine, I),在DNA复制或修复过程中,I通常会被视为鸟嘌呤(Guanine, G),因此最终实现A→G的碱基转换。
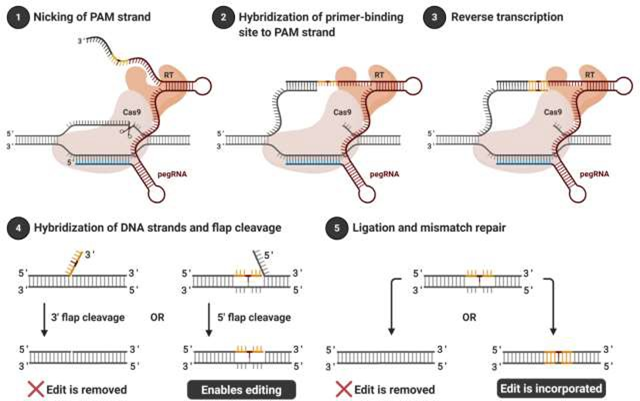
引导编辑通过结合nCas9与逆转录酶以及一种经过改造的sgRNA(pegRNA)来工作。nCas9在PAM序列的下游、目标序列中的特定位点对PAM链进行单链切割(nicking),逆转录酶使用pegRNA提供的模板合成新的DNA序列,与目标DNA配对。在新DNA片段与目标DNA杂交的过程中,目标DNA原先的序列(未匹配的单链)会被识别为“悬链(flap)”,在DNA修复机制中被特定核酸酶识别并切除。
基因编辑治疗产品
基因编辑治疗产品主要分为两大类,分别是涉及体内基因编辑和体外基因编辑。体内基因编辑主要通过病毒载体或纳米颗粒等方式将基因编辑组件直接注射到体内;体外基因编辑则是将细胞先从人体内取出,在体外对细胞进行基因编辑,然后将经过改造的细胞重新输入到人体中。
在开发基因治疗相关的产品时,需要考虑以下几点:
• 基因修饰的种类和修饰程度;
• DNA序列改变的机制;
• 产品的设计和基因编辑组件传递的方式;
— 用体内还是体外编辑方法;
— 传递组件的载体有病毒、纳米颗粒、质粒DNA,mRNA、蛋白(核糖核蛋白)。
• 优化基因编辑组件以确保基因编辑正确;
• 目的编辑和脱靶编辑的研究,监测序列的变化、基因表达情况、下游基因序列的表达功能;
• 临床试验设计、病人的监测、长期随访。
基于以上考虑要素,基因治疗产品在设计时需要基于科学和风险评估,即根据产品的作用机制和安全性,考虑基因编辑可能会引起的疾病,非目的基因编辑发生的风险以及基因编辑产生的长期影响。在保证基因治疗产品的质量上需要从起始物料和相关成分开始把控,包括生产工艺的控制以及最后产品的放行和质量研究。
基因编辑组件包括核酸酶、目的原件、供体模板等。如果是基于体内基因编辑的治疗产品,基因编辑组件通常是以活性药物成分(active drug ingredient,API)直接输入体内;如果是基于体外基因编辑的产品,基因编辑组件则作为关键物料。
• 不管是作为API还是关键物料,IND申报材料中都需要对基因编辑组件的设计、生产和检测进行详细描述;
• 基因编辑组件的生产要求需要根据临床研究满足适当的cGMP原则。1期临床对cGMP的要求可以参考“FDA Guidance for Industry: CGMP for Phase 1 Investigational Drugs“,2期临床及以后需要完全符合cGMP条件;
• 基因编辑组件需要根据生产制定质量标准,标准中要对其安全项、鉴别、纯度、活性、残留进行规定。尤其是体外基因编辑治疗产品,需要对产品中残留的基因编辑成分进行监测,并研究脱靶、染色体易位等情况;
• 基因编辑组件也要开展稳定性研究。
基因编辑的安全性考虑要素包括以下几点:
• 脱靶编辑;
• 目的基因编辑后产生的非预期的生物功能,比如非精准DNA修复下的基因突变;
• 目的编辑和非目的编辑的DNA剪切发生的染色体易位、翻转等负面影响;
• 由基因编辑组件、编辑结果或传递系统引起的免疫原性反应。
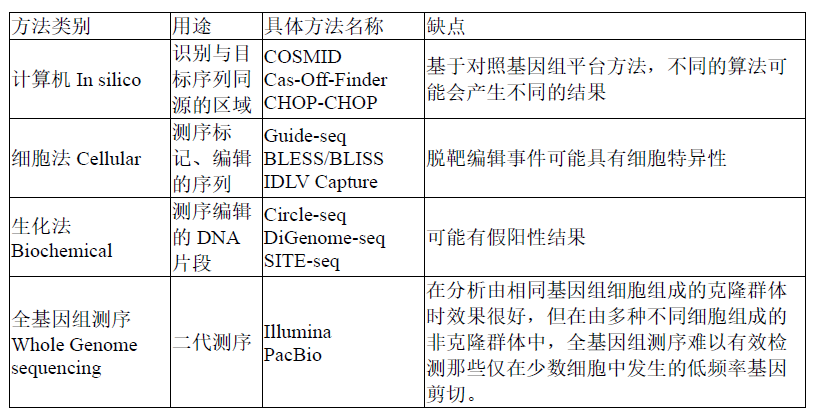
对可能发生的非预期基因修饰需要进行评估分析,选择合适的方法,比如选择正交方法从多维度角度分析,提供实验分析的细节,包括参数设定、序列检测深度和检测质量,列出观察到的非目的编辑的注解;对个体之间存在的基因编辑的差异进行解释说明;尽可能对非预期编辑产生的生物功能影响进行解析。下表中列举了一些常用的研究脱靶编辑的检测方法,尽管这些方法在不断完善,但目前现存方法多少都有其缺陷,因此,它们需要配合使用。
此外,以下还列举了一些染色体修饰鉴别的方法:
• In silico模型
• 细胞法
— 基因组图像分析,比如BioNano, FISH, karyotyping
• 生化法
— 单向测序法(Unidirectional sequencing), 比如HTGTS, AMP-seq, UDiTaS
原视频
参考指南
• Human Gene Therapy Products Incorporating Human Genome Editing
— Provides recommendations for information that should be provided in an IND application to assess the safety and quality of the investigational GE product.
— Human Gene Therapy Products Incorporating Human Genome Editing.
• FDA CBER Webinar
— FDA CBER Webinar: Human Gene Therapy Products Incorporating Human Genome Editing.
