根据美国联邦食品,药品和化妆品法案要求,申请人应告知FDA上市申请后涉及的变更(比如产品、生产工艺、质控、设备、设施标签等)。变更报告根据变更后对产品的影响进行等级划分,包括变更后产品的性质、规格、质量、纯度、活性等可能影响产品安全性和有效性的因素。变更等级可分为以下几类:
• 重大变更——必须得到FDA批准后方可执行的变更(prior approval supplement,PAS)
• 中等变更——告知FDA后需等待30天方可执行的变更(changes being effected in 30 days,CBE-30)或告知FDA的同时即可执行的变更(changes being effected)
• 微小变更——可以执行后再告知FDA的变更(annual report),可通过年报形式递交
FDA对包装系统(container closure system,CCS)的变更评估同样基于风险程度,更换包装系统的元素、组件、容器类型、供应商等都需要考虑其是否会对特定产品的性质产生影响。FDA建议参考ICH Q9 (R1) Quality Risk Management (May 2023) 中的风险管理原则以及ICH Q12 Technical and Regulatory Considerations for Pharmaceutical Product Lifecycle Management (May 2021) 中的风险管理工具。包装系统的适用性和相容性不仅取决于容器的性质,还取决于包装系统其他成分的性质以及它们在预定保质期内与药品处方的相互作用。申请人必须在分销产品前完成变更的验证和评估,评估内容比如:高pH对处方属性的影响,玻璃分层、颗粒物质、可浸出物或不稳定分子与可浸出物相互作用等因素带来的影响(如某些蛋白质与金属离子相互作用的敏感性),冻干工艺对产品质量的影响。最终,应按照USP有关章节的方法对变更后的小瓶的适用性进行验证。指南附件表格中明确了包装容器各类变更建议递交的内容以及报告变更等级,详见下表。
表1 玻璃瓶和瓶塞性质的变更:NDA/ANDA
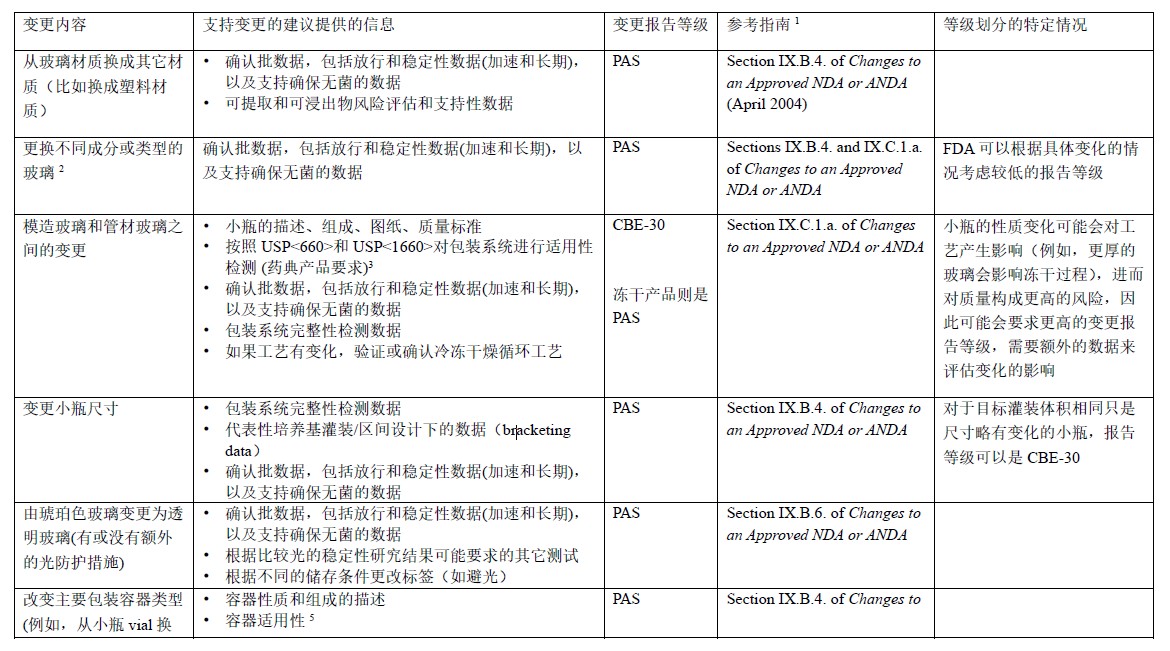
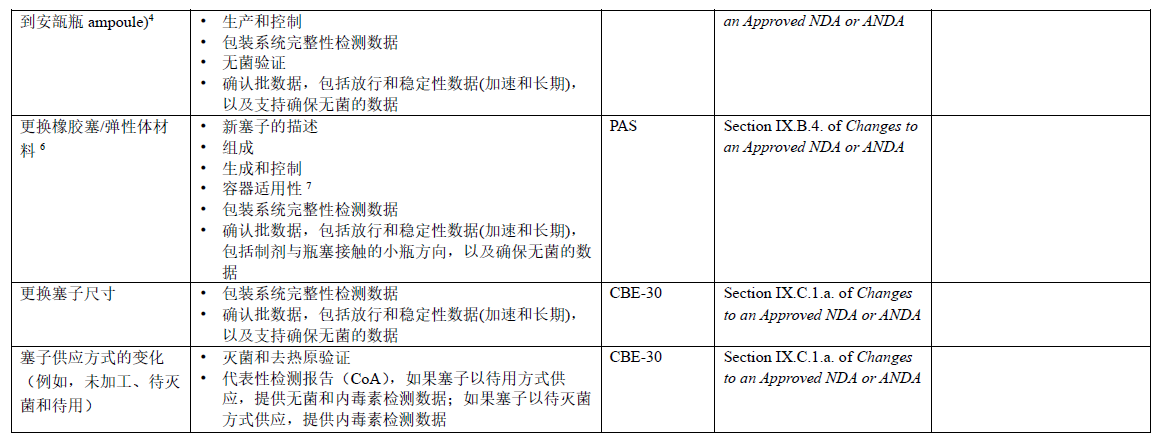
1 指南会定期更新,详见FDA官网https://www.fda.gov/regulatory-information/search-fda-guidance-documents
2 更换玻璃供应商,但不改变玻璃类型或涂层,也不改变容器/封口尺寸,可作为年报递交,详见指南CMC Postapproval Manufacturing Changes To Be Documented in Annual Reports (March 2014) 附录中的5.4章节。
3 USP <660> Glass Containers Used in Pharmaceutical Packaging/Delivery Systems, USP <1660> Evaluation of the Inner Surface Durability of Glass Containers
4 根据具体情况,有些确定的变更可能更适合作为原始申请提交,而不是作为补充申请。 这种类型的变更可能也要更改标签。如有疑问,申请人可向CDER或CBER部门咨询。
5 待更换使用的玻璃的适用性,包括其防护功能(如无菌容器完整性)、安全性(如可萃取物和可浸出物)及性能。参考USP<660>和USP<1660>。
6 当更换瓶塞供应商时,如果当前批准的供应商的瓶塞和待更换使用的供应商的瓶塞的特性不同或制造工艺发生变化,变更需要以更高级别报告- PAS;如果塞子性能和制造工艺的差异很小,则可以报告较低级别。
7 有关塞子的适用性信息,应参考USP<381>,包括其保护功能(如无菌容器完整性)、安全性(如可萃取物和可浸出物)和性能。
表2 玻璃瓶和瓶塞性质的变更:BLA
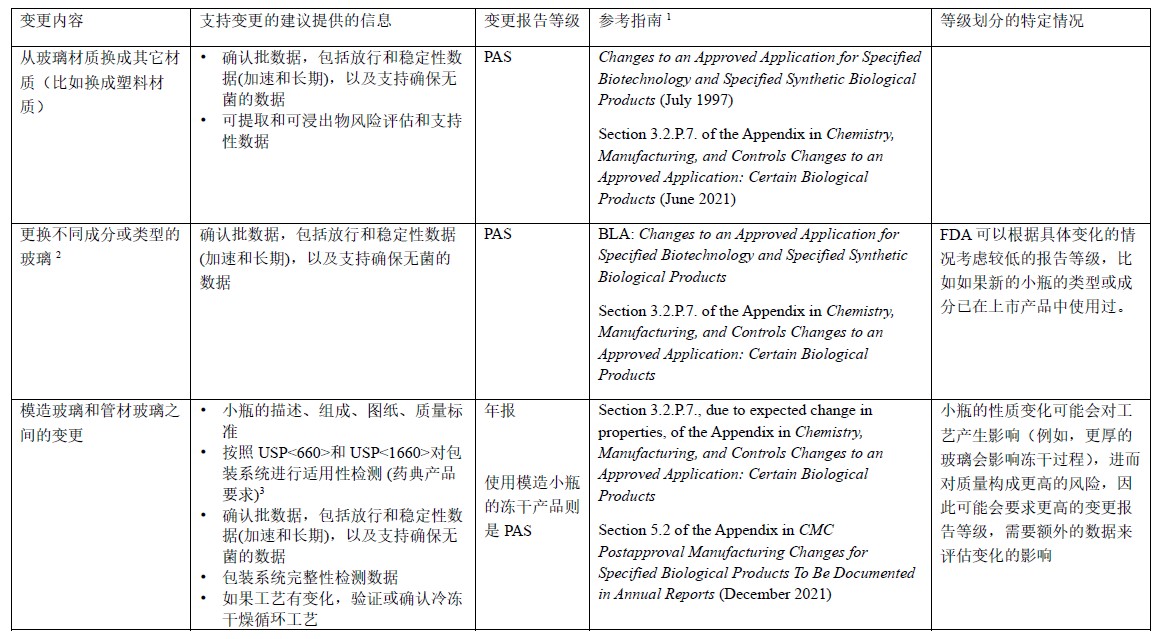
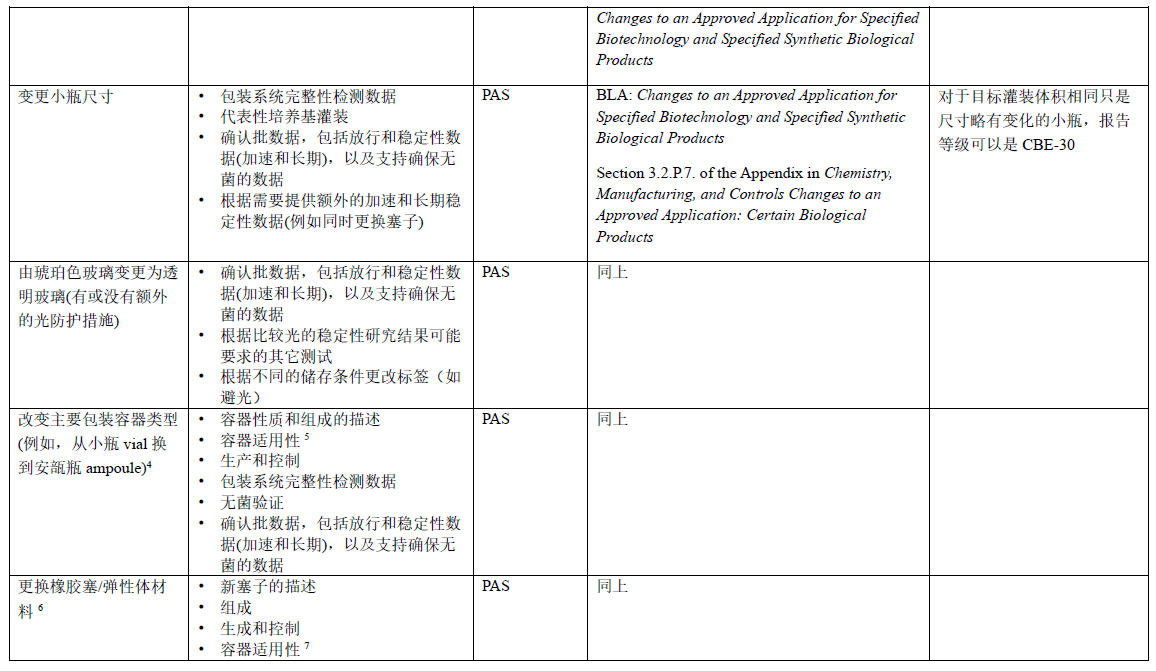
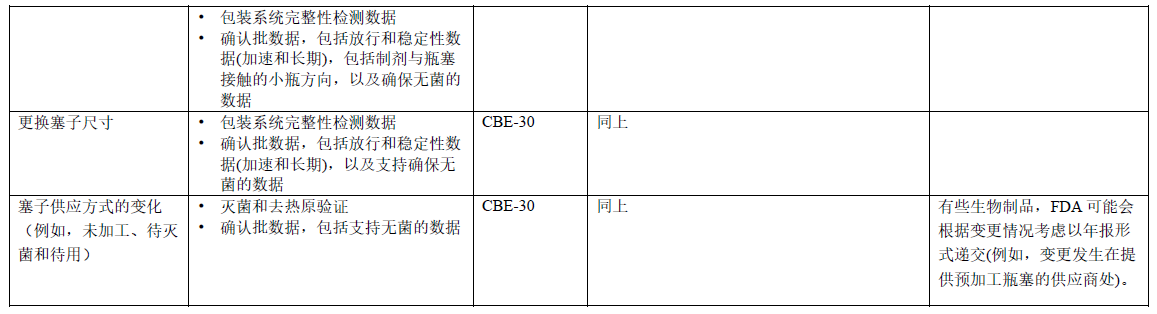
2 如果产品接触材料或维度(尺寸和形状)没有变化,则可以在年报中报告这一变更。 参考指南Chemistry, Manufacturing, and Controls Changes to an Approved Application: Certain Biological Products中的附录3.2.P.7 章节。
其它备注参考表1备注
表3 玻璃瓶和瓶塞生产地或生产商的变更:NDA/ANDA
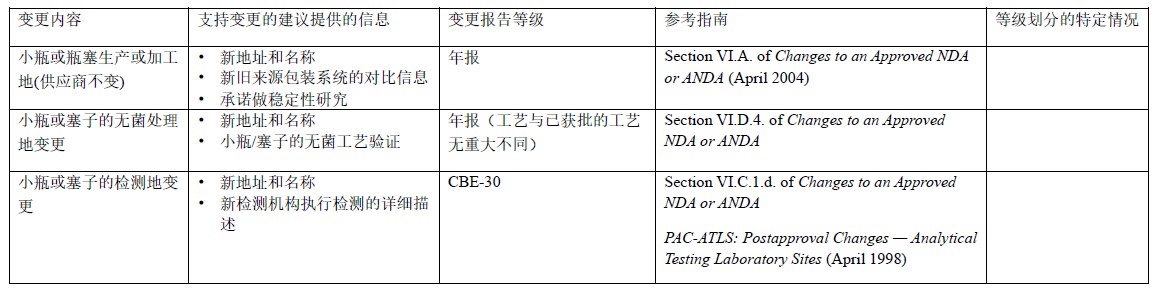
表4 玻璃瓶和瓶塞生产地或生产商的变更:BLA
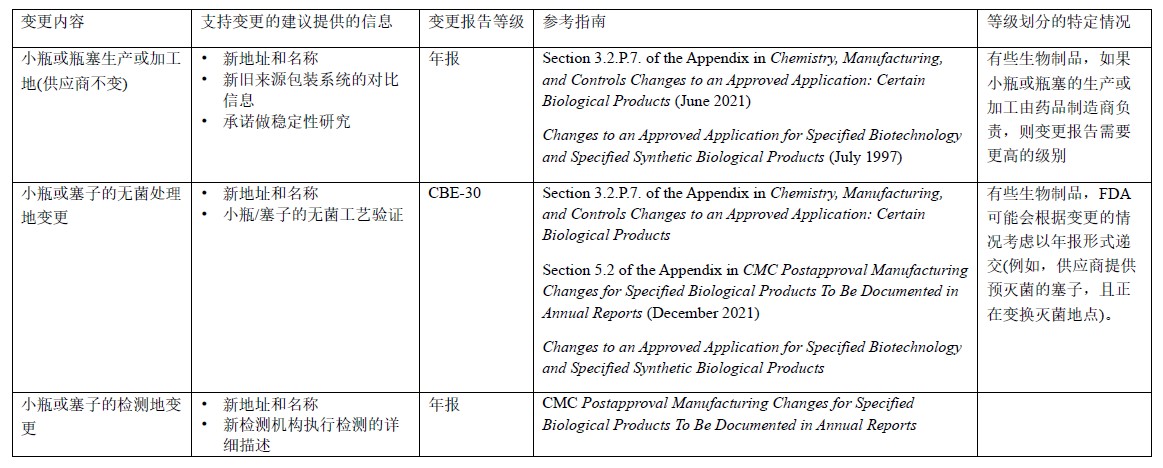
表5 玻璃瓶和瓶塞生产或加工的变更:NDA/ANDA
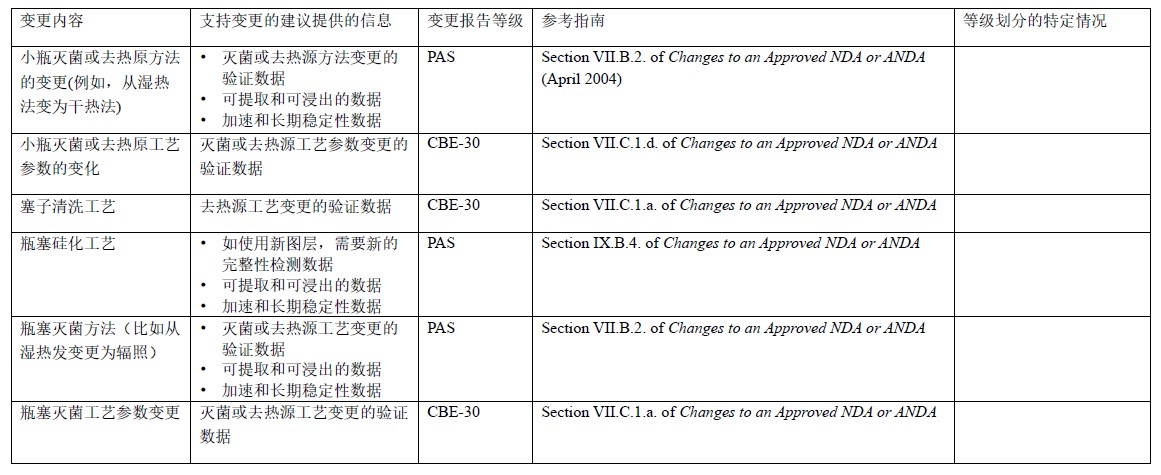
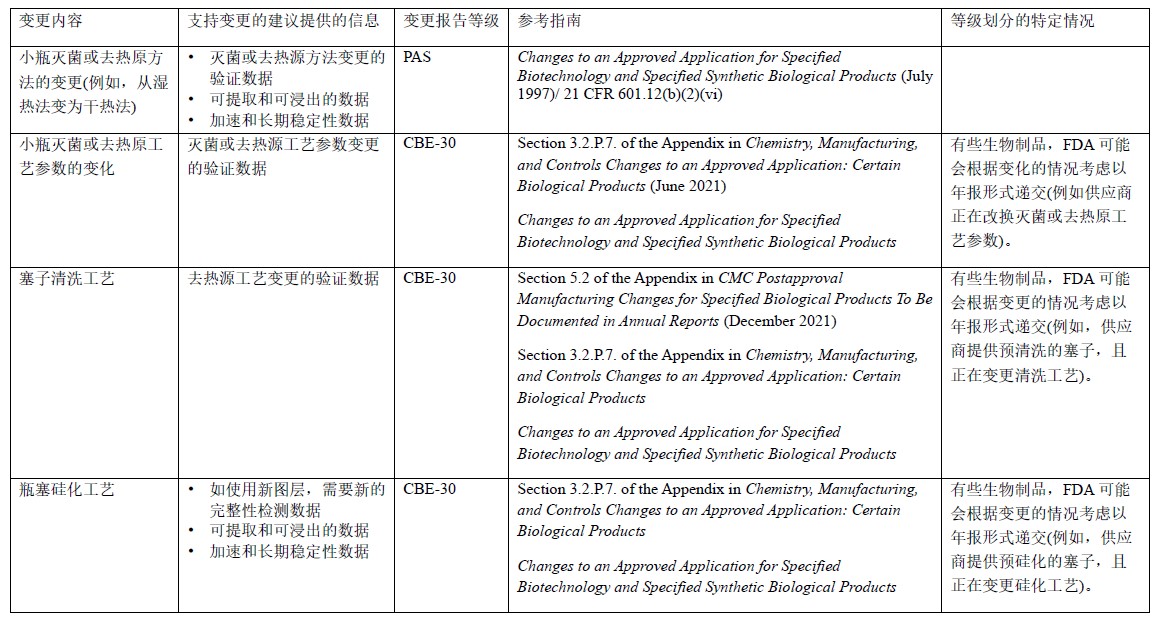
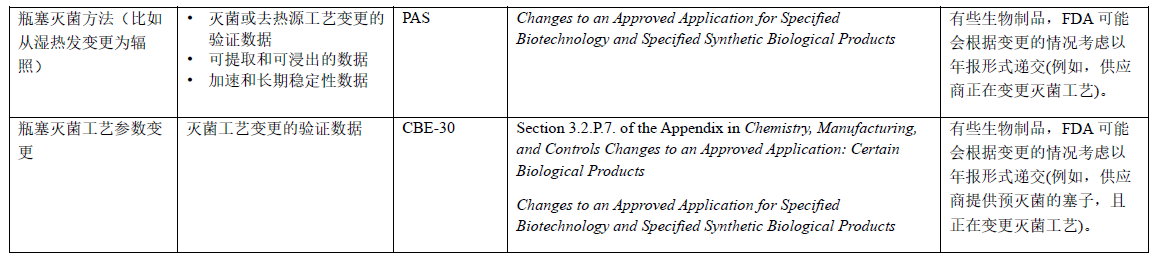
表6 玻璃瓶和瓶塞生产或加工的变更:BLA
撰稿人:Arlie Ling
