1. 计划概述
• 2023财年预算:提供了500万美元的新资金,通过FDA核心运营支持该计划。
• 负责部门:FDA首席科学家办公室负责整体协调和管理,各中心具体执行计划目标。
• 主要目标:
♢ 拓展监管认可的替代方法流程;
♢ 提供研发替代方法的行业指南;
♢ 填补研究信息空白,以推进政策和指南制定。
与各种外部利益相关者的合作,包括联邦合作伙伴、公共-私人伙伴关系和国际监管机构,对此至关重要。
2. 资格认证(Qualification)
资格认证是FDA预先评估替代方法在特定使用环境中的可行性和可靠性的过程。
• 认证后的替代方法可在特定场景下被认可,并供产品开发者在合适的范围内放心使用。
• 该概念类似于药物或医疗器械的适应症,即FDA只认可该方法在特定条件下的应用。
什么是“特定使用环境”(Specific Context of Use)?
• 指替代方法的使用方式和目的,即该方法在解决特定问题时的作用和范围。
• 当 FDA 对一种替代方法进行资格认证时,它仅适用于该特定使用环境。
FDA现有的资格认证项目:
• CDER/CBER 药物开发工具(Drug Development Tool, DDT)认证计划。
♢ 动物模型认证计划;
♢ 生物标志物(Biomarker)认证;
♢ 临床结果评估(Clinical Outcome Assessment)认证;
♢ 新药创新科学与技术方法(ISTAND)试点计划(如微生理系统(MPS)、非临床药理/毒理学检测)。
• 医疗器械开发工具(MDDT)认证(如非临床测试模型、临床结果评估、生物标志物测试等)。
示例案例:
• CHRIS(化学风险计算器):2022 年 11 月,FDA医疗器械和放射健康中心(CDRH) 认证了 CHRIS 工具,用于评估色素添加剂的毒性和生物相容性。
• ISTAND 试点计划:2022 年 9 月,CDER 和 CBER 接受首个 ISTAND 申请,用于评估生物治疗药物的非目标蛋白结合性,可能减少或消除部分标准毒理学测试。
3. FDA对工业界的指南
FDA 发布了一系列关于替代方法的行业指南,包括:
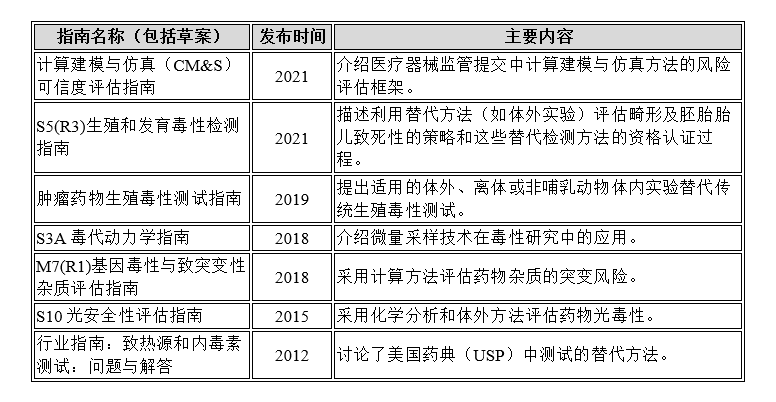
FDA也接受经经济合作与发展组织(OECD)批准的替代方法,例如:
• OECD 437 指南:重建的人角膜上皮模型取代兔眼刺激试验;
• OECD 439 指南:3D重建人体表皮模型用于皮肤刺激评估。
4. FDA内部跨机构工作组
FDA 成立了多个工作组,以支持推进替代方法并减少动物实验的目标。这些工作组主要包括:
(1)替代方法工作组(Alternative Methods Working Group)
成立于2019年,目的是推进FDA预测毒理学路线图(Predictive Toxicology Roadmap)的目标,由FDA各部门的高级审评员和研究人员组成。其重点是推动创新技术的发展,以支持传统毒性和有效性评估的替代方法,覆盖 FDA 监管的所有产品领域。
主要职责:
• 讨论FDA 范围内的新型体外、体内和计算模拟方法,涵盖研究、培训和沟通;
• 促进替代系统(如微生理系统,MPS)的开发和潜在应用,以支持监管毒理学决策;
• 促进FDA 与全球监管机构的合作,推动毒理学领域的替代方法实施;
• 研究新兴方法和技术如何支持 FDA 监管的风险、安全性和有效性评估;
• 通过公私合营伙伴关系,与 FDA 专家和利益相关方合作,确定微生理系统(MPS)的性能标准。
(2)建模与仿真工作组(Modeling and Simulation Working Group)
计算机建模和仿真技术(Computational Modeling and Simulation, CM&S)是一种重要的工具,可以补充传统方法,用于 FDA 监管产品的科学证据收集和政策制定。FDA 科学家经常审查产品提交的建模与仿真结果,并在科学研究和监管决策中应用这些技术。
主要目标:
• 提高对建模和仿真的认知,推动监管科学在公共健康领域的发展;
• 促进利益相关方之间的交流,加强建模和仿真领域的信息共享;
• 作为 FDA 在建模与仿真及新兴技术方面的科学资源;
• 与国内外从事类似活动的组织开展合作;
• 促进 FDA 各中心之间的审查和决策一致性,确保建模和仿真技术在 FDA 内部的标准化应用。
(3)毒理学工作组(Toxicology Working Group)
作为 FDA 推进替代方法的一部分,毒理学工作组在2017年发布了《FDA预测毒理学路线图(Predictive Toxicology Roadmap)》,该路线图概述了FDA在促进毒理学新方法开发和评估方面的思考,并探讨了如何将这些新技术纳入 FDA 监管体系。
这六部分框架概述了FDA在预测毒理学中的优先事项和参与,强调了使用背景的重要性,并确认了与FDA监管产品相关的毒理学问题。FDA的预测毒理学路线图还指出了哪些毒理学领域可能从提升的预测能力和能满足这些需求且支持3Rs的有前景的新技术中受益。
该工作组由来自 FDA 各中心和办公室的高级毒理学家组成,并曾举办多场公开活动,包括2018 年的公开听证会和2019 年的公开研讨会。
注意:FDA 替代方法工作组,建模与仿真工作组和毒理学工作组的活动仅供参考,不作为官方监管指南。
5. 更多FDA项目和计划
FDA推动替代方法的工作示例如下:
• 用于辐射对抗开发的人体器官芯片:FDA资助的一个项目中,科学家们正在开发肺、肠和骨髓等器官芯片辐射损伤模型,用于测试治疗辐射损伤的药物对策。该研究已扩展到开发和评估新型器官芯片,以支持COVID-19对策的开发。
• 人类食品计划(HFP)的器官芯片技术工作:从肝脏芯片开始,FDA的人类食品计划(HFP)将会评估这一技术的有效性,以更好地理解食物中化学物质对人体的影响。
• 通过系统生物学和机器学习加强冠状病毒模型:在本项目期间进行的研究将有助于改进评估现有SARS-CoV-2非临床模型的方法,并利用新颖的方法和技术开发新的模型,这些模型最终可以支持针对COVID-19以及可能出现具有大流行潜力的病原体的医疗对策的开发和评估。
• 三维细胞培养平台:CDER的研究人员正在探索微生理(MPS)平台等替代方法,以增强对药物药理学和毒理学的理解和安全性评估。
• CDRH的虚拟人群(ViP)模型工作:从磁共振成像数据中创建的高分辨率解剖学模型。自其创立以来,ViP模型已成为计算生物物理建模应用的黄金标准。这些模型已在CDRH的600多个上市前应用中被引用和使用。
• 扩大下一代基因组学工具以支持大流行准备和响应:FDA-ARGOS数据库正在帮助研究人员利用计算机建模工具快速验证诊断测试,支持产品开发。
• 跨物种免疫系统参考:一个FDA资助的项目,收集了人类和动物免疫反应的数据,并使用这些数据创建了物种特异性的免疫功能图谱,比较了不同物种之间的差异与相似之处,并映射了与生物威胁因子和潜在医疗对策相关的免疫反应。
• 评估犬类崩解或咀嚼单层组合药物中局部作用、非全身吸收药物的替代方法:本非终结性研究旨在收集数据,支持减少或消除在某些研究中使用犬只,这些研究最终有助于批准用于治疗犬类特定疾病的药物。研究结束后,参与的狗被收养为宠物。
• 监管科学与创新卓越中心(CERSI)项目:利用人脑类器官进行混合神经毒性和个体易感性的研究。
• 在NCTR 2022年年报中突出的国家毒理学研究中心(NCTR)项目。NCTR与替代方法相关的项目包括:
♢ 评估无机砷暴露对斑马鱼的发育神经毒性,用于监管风险评估;
♢ 使用微生理学人类胎盘屏障模型评估药物对胎盘免疫的毒性;
♢ 基于微生理学系统的研究推进:研究寨卡病毒睾丸感染、病毒传播及抗病毒对策
♢ 评估用于评估药物/化学毒性的卵泡发生新型替代模型;
♢ 将药代动力学和不良反应数据与机构批准文件结合使用;“二分法”模型,以改进肝毒性风险评估
♢ 开发人工智能虚拟怀孕女性建模套件,以支持监管决策;
♢ 3D生物打印人类皮肤等效物的表现,用于FDA监管药物和化妆品成分的体外皮肤吸收测试,适用于皮肤及透皮应用;
♢ 建立肝脏芯片系统,用于预测个体对药物引起的肝损伤的易感性和适应性;
♢ 使用诱导性多能干细胞衍生的心肌细胞(iPSC-CMs)进行药物引起的心脏毒性的综合评估;
♢ 开发食品安全的人工智能方法。
• 更多另见FDA联合编写的替代方法相关出版物列表。
6.结论
FDA在推动替代方法的应用方面取得了显著进展,通过引入创新的科学技术和方法,逐步减少了对动物实验的依赖,并提高了药物、安全性评估及生物医学研究的精准度。这些替代方法不仅为药品和医疗设备的安全性和有效性提供了更为高效的评估手段,也为环境保护和人类健康的保障提供了新的研究视角。FDA通过整合微生理学系统、3D生物打印技术、人工智能等先进技术,推动了替代方法的创新发展,预计将为未来的公共卫生挑战提供更加可持续和伦理友好的解决方案。继续强化这些方法的应用,不仅能够提高监管决策的科学性,还能促进全球生物医学研究领域的协作与发展。
撰稿人:Zoey Pang
