讲者简要回顾了从2020年3月13日FDA停止现场检查以来的一些里程碑事件,包括2023年5月重启对中国的现场检查以及对于一些替代工具的使用,比如远程合规评估(remote regulatory assessment,RRA)。在这里提到了四种方式,包括远程交互评估(remote interactive evaluations,RIEs),PIC/S协作,远程查阅记录以及双边信息分享计划(Bilateral information sharing)。
而对于远程合规评估RRA,FDA不仅先后出了相关指南,也有问答供工业界参考,Conducting Remote Regulatory Assessments (fda.gov)。
之后,讲者提到了双边互认机制(Mutual Recognition Agreement,MRA),2017年,FDA第一次与欧盟签订了双边互认机制,2021年与英国重新签订了MRA,2023年与瑞士治疗产品监管局(Swiss Agency for Therapeutic Products ,Swissmedic)签署了MRA,并且对于所使用的产品类型进行了一定的拓展。
最后,讲者建议工业界应该对FDA在检查中的问询积极的进行回复,并确保提供给FDA的信息为及时准确的信息,如果有药物短缺,也应该及时通知FDA。
知识拓展:
双边信息分享计划:这个是指在保密承诺机制(Confidentiality Commitment ,CC) 协议下, FDA与其他的组织进行信息的分享。CC旨在为美国食品药品监管局(FDA)与其他国家的监管机构和国际组织在合作执法或监管活动中共享某些非公开信息建立法律框架。在FDA与对方国家的监管机构分享非公开信息之前,必须先建立CC,但CC从不要求FDA必须(或其对方)分享信息。
FDA与国外药品监管机构进行双边和多边合作,共同致力于特定主题和治疗领域的合作。下表列出了FDA当前参与的一些持续进行中的双边信息分享计划。
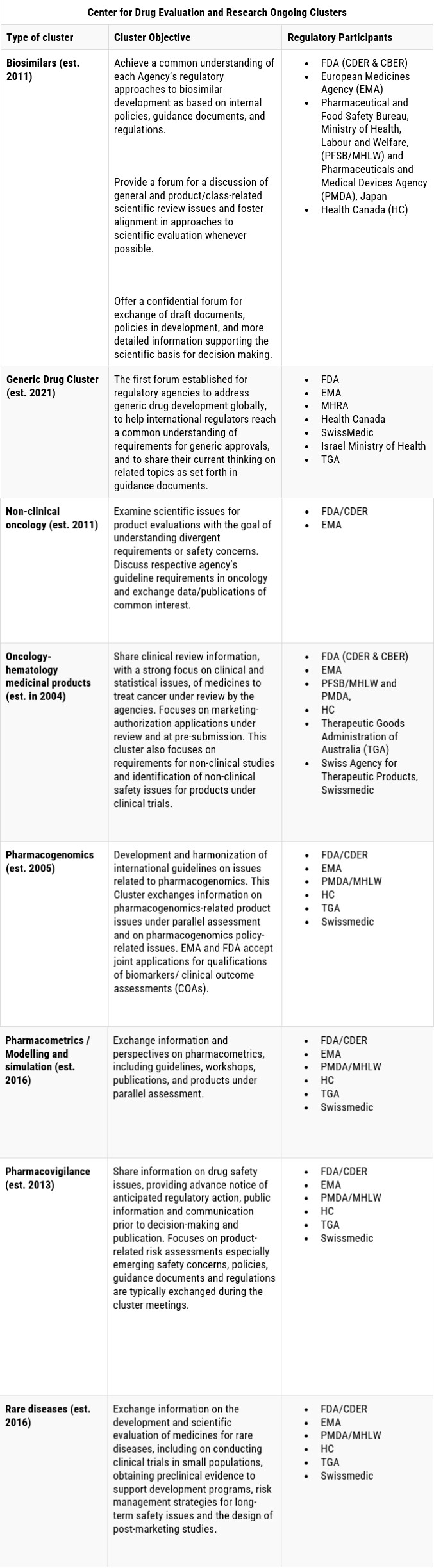
双边互认机制(Mutual Recognition Agreement,MRA):
MRA为美国FDA与协议成员国在MRA 框架下,双方对于常规监察的结果为相互接受和认可。当然MRA协议下的监察也有局限性,不包含以下监察,但是可能将来会加入到MRA协议中
For U.S.-EU MRA and U.S.-UK MRA
1. 人用疫苗
2. 血浆衍生药品”或“血浆制品药物
3. 研究产品(临床试验材料),具体根据每项协议而定
U.S.-Switzerland MRA
1. 人用疫苗
更多资料可参考:https://www.fda.gov/international-programs/international-arrangements/mutual-recognition-agreements-mra
声明:本文内容部分源于FDA官网信息,中文翻译仅代表HPC观点,如有意见或想法,欢迎联系我们或留言,感谢。
