详情见下方链接:
https://sbiaevents.com/files2023/SEND-Webinar-Slides-2023-11-16.pdf
OCS隶属于CDER的转化科学办公室(OTS)。OCS的使命和愿景是通过集成数据、工具和培训来改进科学审评过程,为CDER审评人员提供创新和可靠的解决方案;通过实施工具、服务和培训,推动 CDER 科学审评流程的现代化。
图:PDF截图
SEND,Standard for Exchange of Nonclinical Data,是FDA要求递交非临床数据的标准格式。该标准由临床数据交换标准协会(Clinical Data Inter-change Standards Consortium, CDISC)的SEND团队定义并维护。业界经常提到的SEND是指SEND数据集(Dataset),是集合了不同文件格式的数据集文件,主要由domain .xpt,define .xml 和 nsdrg .pdf组成。自2017年12月18日起,CDER要求申请 IND 的一般毒性试验必须采用 SEND 格式。2019年3月15日之后开始的、申请 NDA 和 BLA 的安全药理试验以及 2020 年 3 月 15 日之后开始的、申请 IND的安全药理试验,也被要求以 SEND 格式递交。SENDIGv3.0支持单次给药的一般毒理试验,重复给药的一般毒理试验和致癌性试验。SENDIG v3.1补充支持呼吸和心血管安全药理试验。
以下是对会议内容的概述,主要集中讨论了OCS 非临床服务和安全药理实验 SEND data 递交的常见问题:
OCS非临床服务
通过对2022财年和2023财年OCS非临床服务完成情况的分析,FDA发现在过去的5年中,包含SEND数据集的安全药理研究数量大幅增加。故完整、正确的SEND数据集对于FDA审评人员对其的使用至关重要。因此,OCS非临床服务团队为Pharm/Tox审评人员提供不同级别的服务,根据审评人员的SEND经验提供最适当级别的支持,使他们能够最大限度地利用这些数据。
OCS非临床服务共分为2个等级。其中一级服务分为2部分:1A是主动提供初步的数据质量评估,1B是通过主动向审评人员提供研究报告中未明确反映的结果/趋势的可视化信息来展示SEND的实用性。二级服务是以培训为重点、基于请求的服务,提供一对一的工具(Tools)演练、问答和深入的数据质量分析。同时,对于首次提供二级服务,OCS非临床小组会进行主题培训,主要包括域(Domines),受控术语,nSDRG概述,以及对定义文件的介绍。
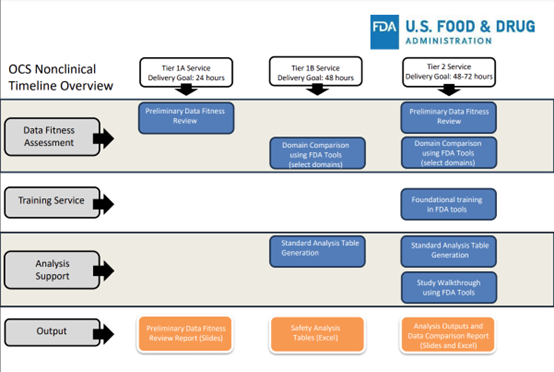
图:PDF截图
提交安全药理学研究SEND数据的常见问题
影响单一研究审查/分析的SEND 问题主要包括:
• 元素定义不正确
• 研究结果中没有使用与暴露(EX)或受试者元素(SE)匹配的给药天数/日期
• 使用剂量相关的实际时间而非名义时间作为时间点报告
• 相同的时间点标签在不同的日期有不同的时间点编号
• 给药后间隔使用:ELTM=PT0H
其他不影响 FDA 单项研究分析工具使用的SEND 问题/不明确的地方包括:
• 研究类型(STYP)、研究类别不正确
• 多个研究类别值
• 未正确使用时段(EPOCH)
• 标签和代码设置不是一一对应关系
• 在开始日期和时间(SESTDTC)同时存在治疗和后续静止/洗脱元素
可能影响交叉设计研究一致性的问题包括:
• 未明确应汇总结果的剂量水平变量
• 未将元素和/或EPOCH定义为治疗/不治疗
• 当治疗后有静止/洗脱期时,治疗元素的预期范围不明确
• 当研究报告中包含多个基线变化计算时,如何解释基线标志
• 给药频率变化的定义和受控术语不明确
• EPOCH定义不明确
• 未定义 ELTM/-TPT内容的选项
总体而言,FDA对影响单项研究审评/分析的问题,其他不影响 FDA 单项研究分析工具使用的问题,以及SENDIG中可能影响交叉研究一致性的问题/不明确的地方进行了汇总和详细的说明。FDA观察到在不同的研究之间和同一个研究内部,标准的执行存在不一致,而这些不一致并不能归因于研究设计或SENDIG语言。遵守SEND标准,并考虑对由此产生的 SEND 文件进行分析,将使 FDA 能够更容易地将这些数据用于安全性分析。
