引言
实时肿瘤学审评(RTOR, Real-Time Oncology Review)是FDA卓越肿瘤中心(OCE)与肿瘤疾病办公室(OOD)共同推出的加速肿瘤药物审评计划之一。最初,该计划仅限于接受设计简单、终点指标易解释的补充申请(Supplement)。然而,后来其范围已扩展至包括新分子实体(NME)等首次上市申请(NDA或BLA)。
FDA于2023年11月8日发布了RTOR的最终指南[1],详细解释了RTOR的背景、申请标准、操作流程以及其他注意事项。尽管与2022年7月22日发布的RTOR指南草案相比,最终指南内容差异不大,但对公众提出的意见进行了解释和添加了示例。本文将综合最终指南对RTOR计划进行介绍。
背景
在传统的FDA药物审评过程中,药物上市申请包含了疗效和安全性数据以及所有其他要素(例如行政信息、摘要文件、非临床研究报告、临床研究报告、化学生产和制造信息等)。然而,准备和组装药物申请的过程通常需要数月时间。RTOR的目标是允许将这些申请信息分阶段递交,使FDA能够更早对关键的疗效和安全性数据进行评估和提供反馈意见。与滚动审评(Rolling Review)不同,RTOR的分阶段递交并不要求包含完整的CTD模块。
RTOR的申请标准
相对于RTOR指南草案中的语言 “straightforward study designs as determined by the review division and the OCE”,终版指南对符合标准的解释更加具体,并且给出了示例。
要想参加RTOR项目必须符合3个基本条件:
1、充分且有良好对照的研究(adequate and well-controlled investigation)表明,该药物在临床相关的终点上可能比现有疗法有显著改善。
2、有FDA审查部门和OCE确定的易于解释的临床试验终点(例如,总生存率,响应率)。
3、该申请不太可能需要更长时间的审查时间(例如,对新的REMS的要求,需要咨询委员会的介入等)。
RTOR的操作流程
1、准备申请材料:在取得关键临床的Topline结果,且完成数据锁库后,申请人可以向RPM请求RTOR申请表,并在IND中递交RTOR申请。请求材料包括:
• 关键临床的Topline结果
• RTOR申请信息,包括满足RTOR要求的证明
• 拟定的RTOR申请各部分提交时间表
2、申请选择:FDA主任/副主任与审查团队将决定是否将该申请纳入RTOR项目。该决定通常在收到请求后的20个工作日内作出,并通过电子邮件通知申请人。
3、电话会议:一旦选择了申请,FDA与申请人可能安排电话会议,讨论RTOR计划和预期提交时间表。确定申请的提交时间表和审查计划,涉及OOD临床分部主任/副主任、审查团队和OCE工作人员。
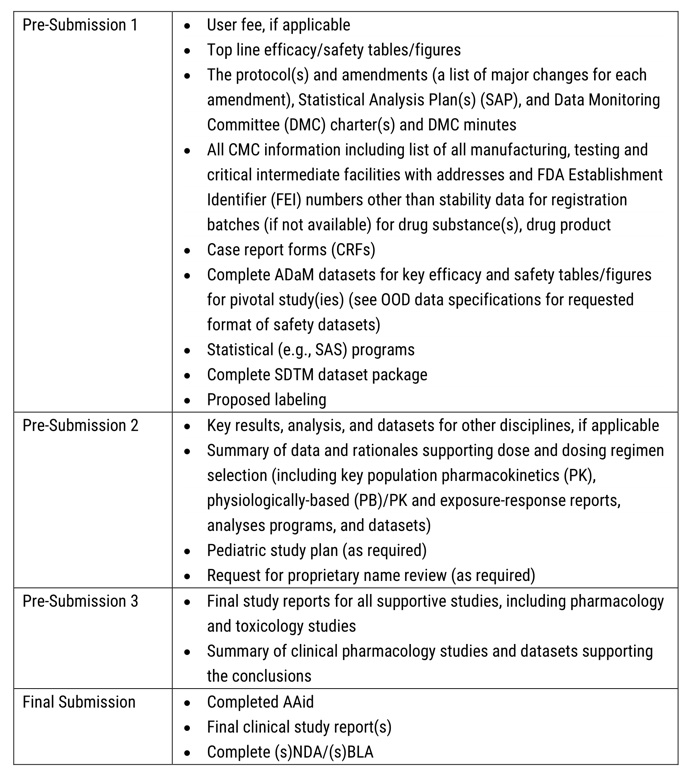
4、分阶段提交材料:申请人按照确认的时间表分次提交申请材料。FDA建议最多进行三次预提交和一次最终提交。
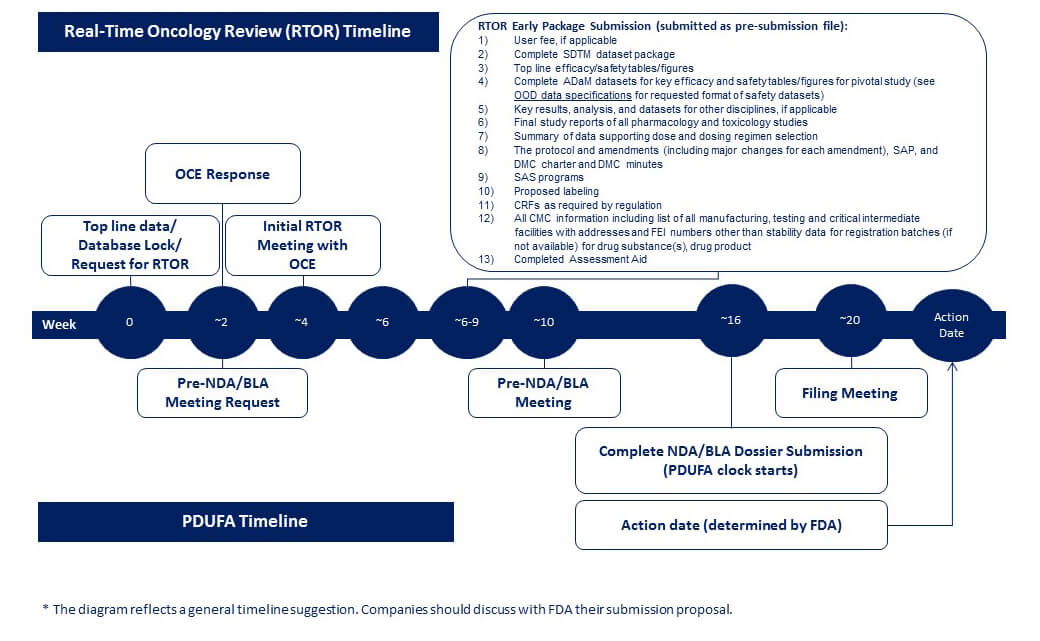 图1:FDA建议的RTOR时间线(来源:FDA官网)
图1:FDA建议的RTOR时间线(来源:FDA官网)表1:FDA给出的RTOR分次递交内容(来源:FDA官网)
其他法规方面的注意事项
指南最后还明确了关于文件递交的一些细节要求,并且明确项目如果根据PDUFA的要求需要交NDA或BLA申请费,则该费用必须在提交RTOR的第一个组成部分时缴纳。
关于RTOR实施效果的回顾性分析
参与RTOR计划需要申请人付出额外的资源,以确保与FDA进行高频沟通,并准确掌握申报时间线。这种付出是否真的能够达到RTOR计划的初衷,即缩短药物审评时间?关于这点,以下几个研究进行了回顾性分析和讨论。
首篇文章来自OCE的de Claro RA等[2],该研究回顾了2018年2月至2020年4月参与RTOR的20个肿瘤药项目,其中包括18个补充申请和2个新分子实体(NME)的上市申请。文章还对比了同时期参加和未参与RTOR计划的项目在获批时间方面的差异。结果显示,参与RTOR项目的补充申请和NME申请的平均审评时间分别缩短了2.7个月和2.2个月。
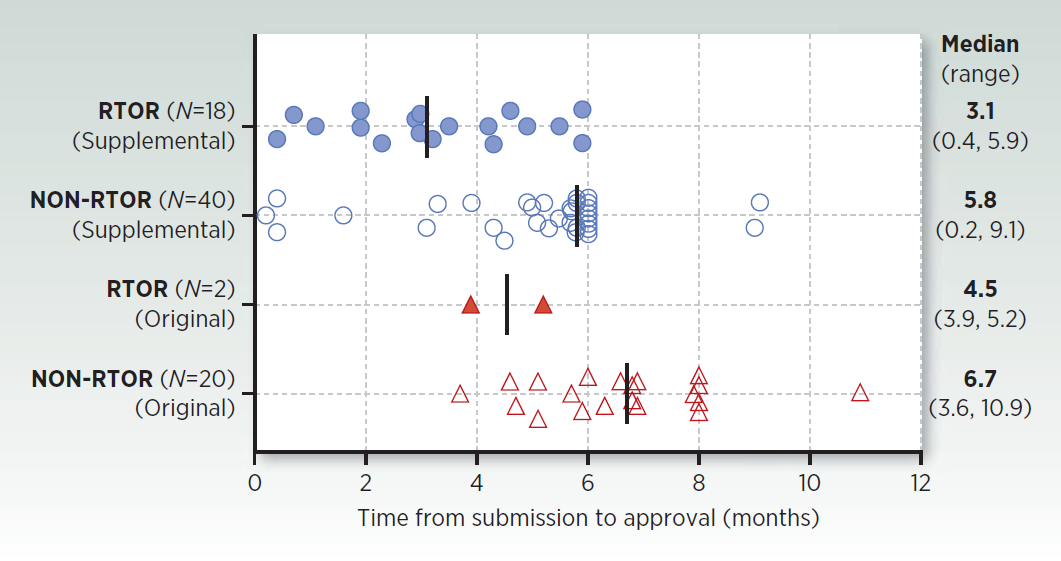
图2:RTOR和非RTOR下肿瘤申请的FDA批准时间对比(2018年2月-2020年4月)[2]
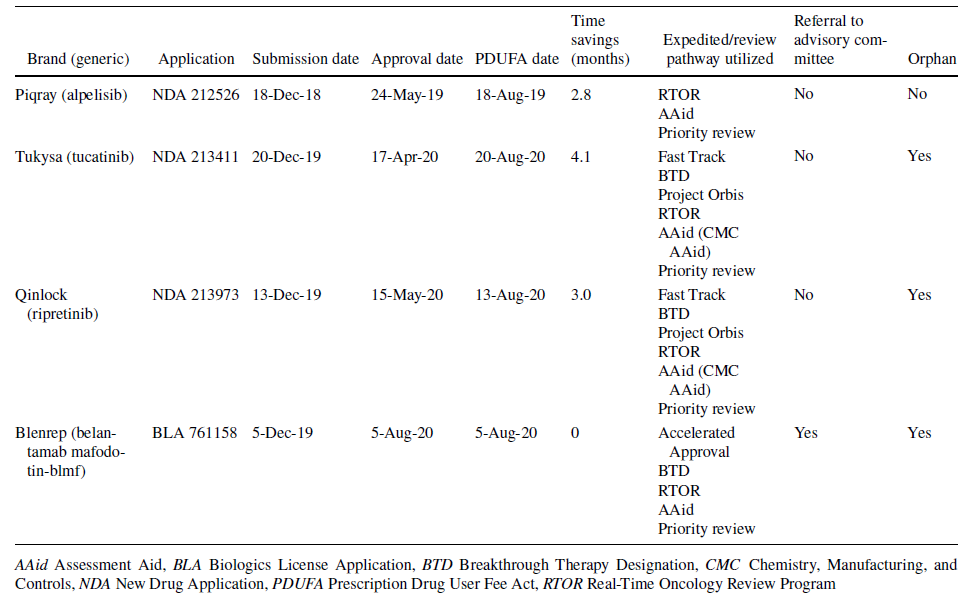
Feng C等人[3]的研究时间跨度较de Claro等人更长,他们分析了2018年2月至2020年8月参与RTOR项目的28个案例,包括24个补充申请和4个新分子实体(NME)申请。这四个NME申请分别为Piqray (alpelisib)、Tukysa (tucatinib)、Qinlock (ripretinib)和Blenrep (belantamab mafodotin-blmf)。与PUDFA的标准时间线相比,这四个申请分别节省了2.8、4.1、3.0和0个月。研究还对这四个案例进行了详细分析,为希望参与RTOR项目的申请人提供了有益的经验教训。
表2:4个通过RTOR计划的NME的NDA/BLA申请情况[3]
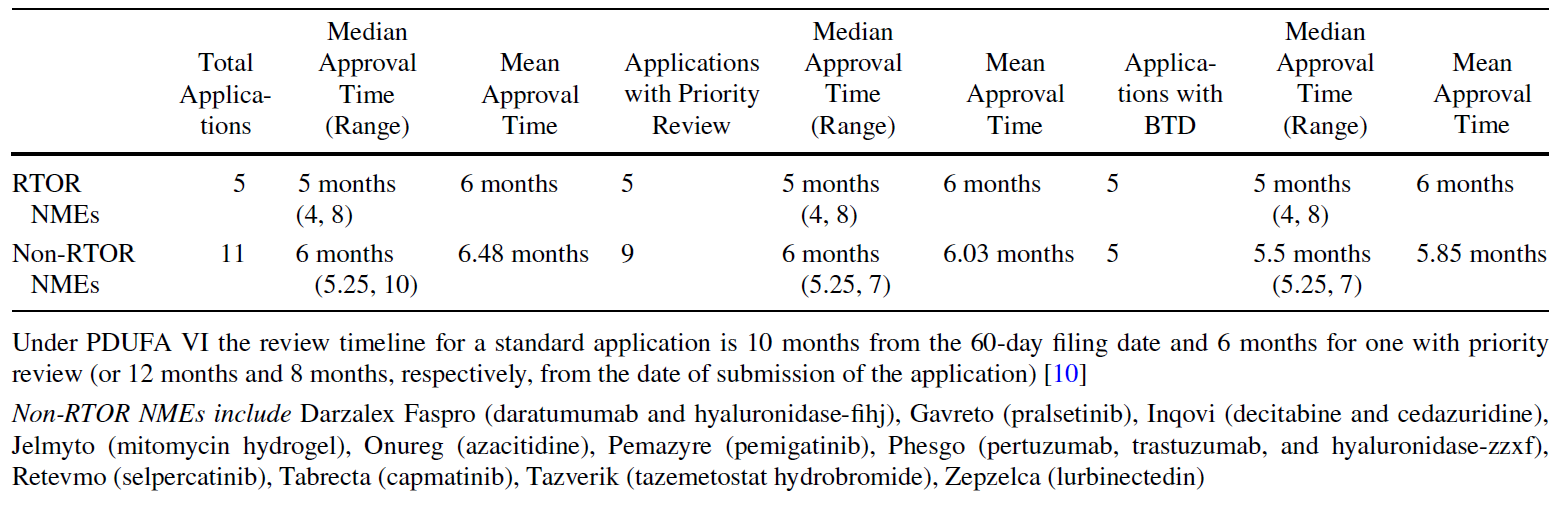
Gao YG等人[4]于2022年1月发表的文章中,对2020年肿瘤领域新分子实体(NME)的批准情况进行了回顾分析。其中,参与实时肿瘤学审评(RTOR)的5个NME平均获批时间为6个月,相较于未参与RTOR的NME,平均获批时间缩短了0.48个月。此外,该文还总结了Genentech公司从2019年2月至2021年7月参与RTOR的经验。
表3:参与和未参与RTOR的2020年获批的肿瘤领域NME [4]
此外,美国制药科学家协会(AAPS)的化学、制造和控制(CMC)社区于2021年8月27日主办了一场关于RTOR的在线研讨会,会议聚集了来自FDA、制药和生物技术行业的代表。讨论的主要议题包括:使用RTOR进行CMC的经验、RTOR与其他加速计划的相似之处和差异、提升CMC工作流效率的机会、提供RTOR的CMC信息时导致延迟的因素以及改进的挑战和机会等[5]。
参考文献
1. U.S. FDA. Real-Time Oncology Review (RTOR) Guidance for Industry. 2023.11
2. de Claro RA, Gao JJ, Kim T, et al. U.S. Food and Drug Administration: Initial Experience with the Real-Time Oncology Review Program. Clin Cancer Res. 2021;27(1):11-14. doi:10.1158/1078-0432.CCR-20-2220
3. Feng C, Virparia R, Mui ET. Analysis of the Real-Time Oncology Review (RTOR) Pilot Program for Approvals of New Molecular Entities. Ther Innov Regul Sci. 2021;55(4):881-888. doi:10.1007/s43441-021-00296-7
4. Gao YG, Roberts S, Guy A. Maximizing Regulatory Review Efficiency: The Evolution of the FDA OCE RTOR Pilot. Ther Innov Regul Sci. 2022;56(2):212-219. doi:10.1007/s43441-021-00371-z
5. Algorri M, Acharya A, Bernstein J, et al. Meeting report: Advancing accelerated regulatory review with Real-Time Oncology Review (RTOR), Project Orbis, and the Product Quality Assessment Aid. AAPS Open. 2022;8(1):19. doi:10.1186/s41120-022-00066-1
